洪宇植,特聘教授、博士生导师(基础医学与生物科学学院 & 分子酶学研究所),国家重大人才工程A类入选者(中组部青年项目),江苏特聘教授,中国科学技术大学博士,曾在美国Rutgers大学新泽西医学院先后从事博士后研究和任副研究员。围绕微生物的利用与控制,研究成果发表学术论文50篇,其中在Nature Microbiology、Proc Natl Acad Sci USA、mBio、Biosens Bioelectron、J Antimicrob Chemother、Antimicrob Agents Chemother等期刊发表微生物生理和遗传类SCI论文30篇,英文专著章节2部、译著1部,授权中国发明专利8项(其中1项获产业转化);论文总引1600余次(Google scholar),H-index因子21。安徽省科学技术奖二等奖获得者(排名第2,2012年),《中国抗生素杂志》青年编委,江苏省医学会第九届微生物与免疫学分会青年委员,等。目前主持在研国家级项目2项、省部级项目1项和校特聘教授启动经费1项,已主持完成国家自然科学青年基金、国家“863”计划子课题等6项。
研究兴趣
细菌感染性重大疾病的防治、细胞应激死亡的机理、抗生素杀菌的作用机理、肺炎致病菌致病机理、信号转导、新型药靶发现、新型抗生素研发。
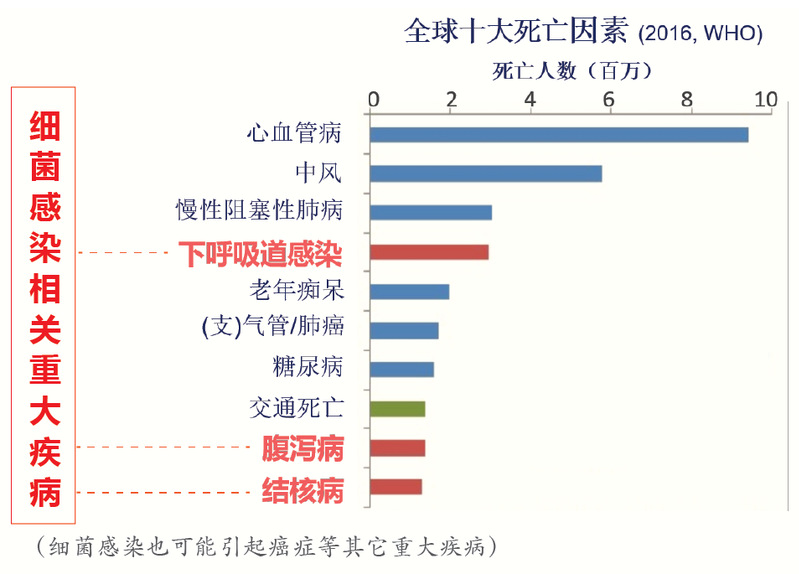
微生物感染在不到一百年以前一直是人类健康的最大威胁;抗生素的发现极大提升了人类健康,保障外科手术实际可行。尽管如此,微生物感染目前仍导致每年1500万人死亡,其中细菌感染导致每年1000万人死亡(即每700人有1人死亡),这些数据往往还不包括癌症、艾滋病患者等免疫低下人群的细菌感染死亡。
随着抗生素的广泛使用乃至滥用,重要病原菌对几乎所有抗生素均产生了严重耐药,目前因耐药而导致的死亡为每年100万人,如果耐药趋势得不到控制,据估计至2050年因耐药而无药可医的死亡将达到每年1000万人。更忧心的是,过去三十年没有开发出一个新种类的抗生素,绝大多数临床细菌感染尚无有效的防治疫苗可用。
为了应对和解决感染领域的这些世界难题,我们“细菌应激与抗生素实验室”基于过去取得创新发现的基础上,致力于细菌应激死亡的机理研究和新型抗生素的研发。我们希望与国内外交叉学科的同行一起努力,力争为临床抗感染治疗提供新思路、新技术、新药物。
招生与招聘信息
硕士生:生化与分子生物学(071010)
欢迎有志于科学研究的同学申报本实验室的博士生、硕士生。
博士后诚聘:热忱欢迎有志于解决细菌感染性疾病难题的优秀博士加盟苏大“细菌应激与抗生素实验室”,专业领域包括(但不限于):微生物学、细胞生物学、生化与分子生物学、病原生物学等生命和医学领域。(![]() 细菌应激与抗生素实验室诚聘博士后研究员.pdf)
细菌应激与抗生素实验室诚聘博士后研究员.pdf)
工作经历
2020.01–至 今, 苏州大学基础医学与生物科学学院、分子酶学研究所,特聘教授、博士生导师;
2017.07–2019.12,美国Rutgers大学新泽西医学院公共健康研究中心,副研究员;
2012.07–2017.06,美国Rutgers大学新泽西医学院公共健康研究中心,博士后;
2005.07–2012.06,安徽大学现代实验技术中心,研习员。
主持在研项目
国家中组部青年项目 (2021-2025)
国家自然科学基金面上项目(2022-2025)
江苏特聘教授项目(2022-2024)
苏州大学特聘教授启动经费(2020-2024)
近期部分代表论文
(Google Scholar引用1600余次: https://scholar.google.co.uk/citations?user=gaJV7SkAAAAJ&hl=en)
Hong Y#, Li Q#, Gao Q, Xie J, Huang H, Drlica K, Zhao X. Reactive oxygen species play a dominant role in all pathways of rapid quinolone-mediated killing. J Antimicrob Chemother. 2020, 75(3):576-585 (# Co-1st authors) (揭示所有喹诺酮类抗生素均依赖ROS快速杀菌的机理。该论文被英国John Innes Centre的Anthony Maxwell教授在F1000Prime上进行正面评论和推荐,认为我们揭示的机理可能对喹诺酮类抗生素的临床应用具有重要启示(Maxwell, A., F1000Prime Recommendation of [Hong Y et al., J Antimicrob Chemother 2019]. In F1000Prime, 2020: DOI: 10.3410/f.737027808.793569172.))
Hong Y, Zeng J, Wang X, Drlica K, Zhao X. Post-stress bacterial cell death mediated by reactive oxygen species. Proc Natl Acad Sci USA, 2019, 116(20):10064-10071.(拓展了教科书半个多世纪以来对经典抗生素杀菌机理的传统认识,发现抗生素介导的靶标初级损伤不足以致死,细菌细胞在撤除抗生素等压力后、能通过ROS 依赖的通路主动应激死亡。论文为该期的亮点文章,并被纽约大学医学院(New York University School of Medicine)的Evgeny Nudler教授在刊发同期专题发表正面评论,认为我们建立了巧妙的技术、第一次证明次级损伤在细胞死亡中的作用(Rasouly A & Nudler E. Reactive oxygen species as the long arm of bactericidal antibiotics. Proc Natl Acad Sci USA 2019, 116 (20): 9696-9698)
Hong Y, Li L, Luan G, Drlica K, Zhao X. Contribution of reactive oxygen species to thymineless death in Escherichia coli. Nature Microbiology, 2017, 2(12): 1667-1675.(揭开了一个困扰科学界60 多年的谜团--“胸腺嘧啶饥饿致死”分子机理:活性氧自由基(ROS)是“胸腺嘧啶饥饿致死”效应的关键致死因子,自由基攻击因胸腺嘧啶(或dTTP)缺失产生并长时间存在的DNA 单链缺口区域,形成致死性双链DNA 断裂,最终导致细菌细胞死亡。该论文被美国贝勒医学院(Baylor College of Medicine)Susan M Rosenberg教授在刊发同期专题发表正面评论,认为我们揭示的机理可能适用于所有生命领域的细胞(Hastings PJ & Rosenberg SM. A radical way to die. Nat Microbiol 2017, 2(12):1582-1583))
近期代表专著
Hong Y, Drlica K, & Zhao X (2018) Antimicrobial-Mediated Bacterial Suicide. Antimicrobial Resistance in the 21st Century, eds Fong IW, Shlaes D, & Drlica K (Springer International Publishing, Cham), pp 619-642.
